Modelos etiologicos del delirium
Delirium
Factores precipitantes
1. Enfermedades
médicas actuales como la insuficiencia cardiaca o respiratoria, anemia, sepsis,
etc., que pueden potenciarse mutuamente.
2. Dolor mal
controlado.
3. Cirugía: el
delirium postoperatorio
4. Los tratamientos farmacológicos constituyen la causa
remediable más común de delirium, contribuyendo al 40 % de los casos.

Causas de delirium
1. Intoxicación por fármacos
y tóxicos:
a)
Fármacos: aminofilina, antiarrítmicos, antibióticos, agentes anticolinérgicos, anticomiciales,
antihipertensivos, antineoplásicos, antiparkinsonianos, sales de bismuto,
cimetidina, corticoides, digitálicos, disulfirán, indometacina, interferón,
litio, opiáceos, ranitidina, salicilatos, sedantes-hipnóticos, etc.
b)
Alcohol: etílico y metílico.
c)
Drogas ilegales: cocaína y fenciclidina.
d)
Inhalantes adictivos: éter, gasolina, nitritos, óxido nitroso, etc.
e)
Tóxicos industriales: monóxido de carbono, metales pesados, disolventes
orgánicos,
insecticidas organofosforados y otros.
f)
Tóxicos de origen vegetal y animal.
2. Síndrome de abstinencia:
a)
Alcohol.
b) Sedantes e hipnóticos: barbitúricos, benzodiacepinas, glutetimida, meprobamato, paraldehido, etc.
c)
Anfetaminas.
3.
Encefalopatías metabólicas:
a)
Hipoxia.
b)
Hipoglucemia.
c)
Secundarias a insuficiencia hepática, pancreática, pulmonar o renal.
d)
Avitaminosis: vitamina B12, ácido fólico, ácido nicotínico, piridoxina, tiamina,
etc.
e)
Hipervitaminosis: intoxicación por vitaminas A y D.
f)
Endocrinopatías: hiperinsulinismo, hiperglucemia hiperosmolar, hipertiroidismo,
hipopituitarismo, enfermedad de Addison, síndrome de Cushing, hipo e
hiperparatiroidismo.
g)
Alteración del metabolismo del agua y electrolitos: deshidratación/intoxicación
acuosa; acidosis/alcalosis; hiper/hipocalcemia; hiper/hiponatremia;
hiper/hipokalemia; hiper/hipomagnesemia.
h)
Errores metabólicos: porfiria, síndrome carcinoide, enfermedad de Wilson, etc.
4. Infecciones:
a)
Intracraneales:
•
Meningitis bacteriana: meningococo, neumococo, Haemophilus influenzae,
tuberculosis, etc.
•
Encefalitis viral: Herpes simple, Herpes zoster, VIH, etc.
•
Infecciones micóticas: criptococosis, coccidiomicosis, histoplasmosis, moniliasis,
mucormicosis, etc.
•
Triquinosis. • Neurosífilis. • Encefalomielitis postinfecciosa y postvacunal.
b)
Sistémicas: fiebre reumática aguda, bacteriemia, brucelosis, difteria,
mononucleosis infecciosa, legionelosis, malaria, parotiditis, psitacosis,
endocarditis bacteriana subaguda, fiebre tifoidea, etc.
5.
Trauma craneal.
6.
Epilepsia. Ictal, interictal, postictal.
7.
Neoplasias.
8.
Enfermedades vasculares:
a)
Cerebrovasculares: AIT, encefalopatía hipertensiva, trombosis, embolismo, hemorragia
subaracnoidea, vasculitis cerebral, demencia multiinfarto, migraña, etc.
b)
Cardiovasculares: infarto de miocardio, insuficiencia cardiaca congestiva,
arritmias,
endocarditis, embolismo pulmonar, etc.
9. Lesiones intracraneales
ocupantes de espacio:
a)
Absceso.
b)
Aneurisma.
c)
Neoplasia (primaria o metastásica).
d)
Hematoma subdural.
10.
Patología hematológica:
a)
Anemia severa.
b)
Poliglobulia.
c)
Púrpura trombótica trombocitopénica.
d)
Macroglobulinemia.
11.
Patología por agentes físicos:
a)
Hipertermia e hipotermia.
b)
Irradiación.
c)
Electrocución.

Prestaremos especial atención a aquellos productos con
efecto psicoactivo, como hipnóticos sedantes y medicaciones con efecto
anticolinérgico. Todos estos son frecuentemente prescritos durante la
hospitalización. La edad avanzada supone un mayor riesgo de interacciones adversas
entre fármacos o entre el fármaco y la
enfermedad.
En la fisiopatología de los cuadros confusionales participan las estructuras y las vías corticales y subcorticales. Las alteraciones en los neurotransmisores relacionados con la formación reticular, el tálamo, la corteza prefrontal y los ganglios basales pueden provocar los síntomas del mismo.
Es conocido que el principal neurotransmisor implicado en este trastorno es la acetilcolina, y de
forma consistente se ha evidenciado que una gran variedad de factores que lo
ocasionan dan lugar a una disminución de
la actividad colinérgica cerebral y en especial, en el haz tegmental dorsal,
conexión entre la formación reticular y el tálamo.
La síntesis de
acetilcolina disminuye significativamente en presencia de hipoxia cerebral e
hipoglucemia y causa un estado hipocolinérgico relativo.
El sistema colinérgico está afectado por la edad y más aún por enfermedades cerebrales degenerativas, que hacen al anciano especialmente susceptible a medicaciones anticolinérgicas.
A mayor edad del paciente y prolongación del cuadro de delirium, más tardía
es su resolución.
Otros autores proponen un desequilibrio entre los mecanismos centrales colinérgicos
y adrenérgicos; o bien un fallo en
el metabolismo oxidativo cerebral o reacción aguda al estrés mediado por una
circulación de corticoides anormalmente alta (Beresin, 1988).
Desde la perspectiva neurobiológica el delirium no puede
ser considerado en la actualidad una manifestación neuropsiquiátrica
inespecífica. Se trata de una entidad fisiopatológica diferente, explicable por
el estrés oxidativo cerebral que media en la disfunción y en el daño de varias
funciones y estructuras cerebrales.
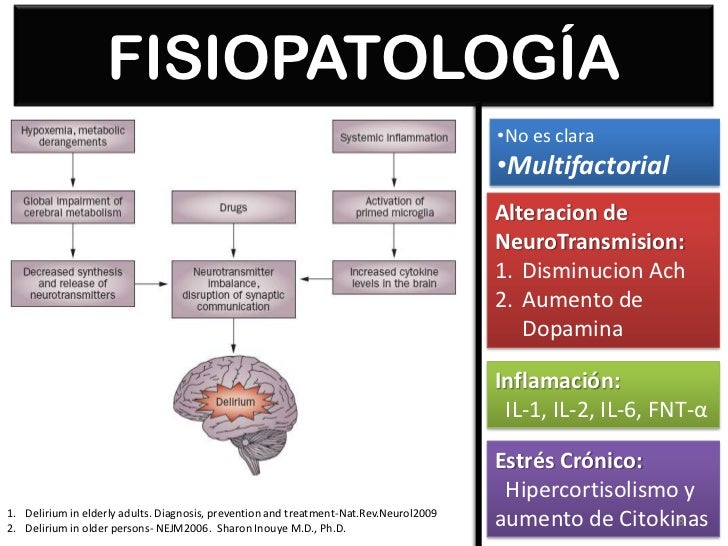
Tiene una naturaleza
progresiva y potencialmente reversible, y un curso fluctuante, en función
de las distintas poblaciones neuronales implicadas.
La afectación
neuronal se inicia en el hipocampo y en la corteza cerebral, continúa en los
núcleos subcorticales y en el tallo cerebral, y acaba dañando al cerebelo y a
la médula espinal con una vulnerabilidad progresiva de tipo selectivo (Brown, 2000).
El deterioro del
metabolismo oxidativo neuronal produce una insuficiente producción de ATP y una disfunción de la membrana neuronal,
con alteraciones en la conducción
del impulso nervioso y en la secreción de
los diferentes neurotransmisores.
Se trata de un proceso
fisiopatológico caracterizado por la disregulación reversible de las estructuras
cerebrales más sensibles a la hipoxia y a otras agresiones externas
(principio de vulnerabilidad selectiva).
Esta disfunción limitada puede progresar hasta afectar a estructuras
más resistentes (principio de vulnerabilidad progresiva), modificando la
estabilidad de la membrana y la despolarización neuronal de forma gradual.
Este fenómeno, al que Leao
denominó depresión neuronal propagada, se extiende geográficamente si se
mantienen los estresores metabólicos responsables, y altera los niveles de varios
neurotransmisores, como se detallará posteriormente.
Las neuronas
hipocampales y el neocortex se afectan precozmente en el delirium porque tienen
una mayor vulnerabilidad selectiva al estrés, con un insuficiente aporte de oxígeno y de ATP, debido principalmente
al elevado cociente entre el área de superficie y el volumen neuronal
Una cantidad
significativa del ATP neuronal
se utiliza en el mantenimiento de los gradientes iónicos a través de la actividad
de las bombas de membrana.
El cerebro humano adulto requiere de 10 a 12 ml de oxígeno por minuto por cada 100 g de tejido (mOmg).
Cuando el suministro de oxígeno cae
hasta 3 mOmg se deteriora de forma proporcional la actividad eléctrica neuronal,
y si llega a ser inferior a 2 mOmg se
produce la parálisis de las bombas iónicas de membrana.
El exceso de flujo
de Ca2+ hacia el interior de la neurona desencadena la mayor parte de las
alteraciones neuroconductuales del delirium.
El estrés
oxidativo aumenta la entrada de Ca2+ y Na+ en el citoplasma celular, mientras
que el K+ tiende a salir de las neuronas.
Estas modificaciones alteran la síntesis y la liberación de
varios neurotransmisores.
La conversión de
dopamina a noradrenalina requiere la
presencia de oxígeno,
por lo que la hipoxia media en una menor
disponibilidad de noradrenalina y en el aumento de la secreción de dopamina.
En condiciones
igualmente de hipoxia los niveles de serotonina disminuyen moderadamente en la corteza cerebral, aumentan en el estriado
y cambian relativamente poco en el tronco cerebral. Supone también una reducción en la síntesis y en la liberación de
acetilcolina que va a correlacionar con la intensidad de las alteraciones
cognitivas y neuroconductuales del delirium.
En las personas
más susceptibles a padecer delirium en situaciones de hipoxia se produce un
aumento del tono dopaminérgico, con una menor transformación de dopamina en noradrenalina, lo que tiene
un efecto facilitador del daño neuronal producido por glutamato.
La hipoxia produce
una mayor secreción de glutamato, que además de estimular una mayor entrada de Ca2+, media en la disregulación y el
daño neuronal sobre todo en presencia de niveles aumentados de dopamina.
La depleción de
dopamina protege de los efectos neurotóxicos de la hipoxia neuronal mediada por
glutamato (Globus et al, 1989).
De forma concordante, en la práctica clínica se observa que
la administración precoz de haloperidol
restaura rápidamente la función hipocampal y cortical.
En situaciones hipóxicas
está disminuida la disponibilidad de COMT, principal
desactivador extracelular de dopamina, y que contribuye por tanto a aumentar
más aún el tono dopaminérgico.
También se reconoce un papel como agentes causales al
aumento de las concentraciones de noradrenalina, y serotonina cerebrales y a
las concentraciones bajas de triptófano. La variación brusca de las
concentraciones de ácido g-aminobutírico del SNC también puede originarlo, lo
que explica que una suspensión brusca de un tratamiento con benzodiacepinas
provoque un cuadro confusional.
Otros neurotransmisores relacionados son los del sistema histaminérgico y los agonistas
opiáceos. Se ha vinculado del mismo modo a las citoquinas, que si en condiciones normales se encuentran en concentraciones
bajas a nivel extracelular, durante el estrés, la inflamación, el crecimiento
tumoral, traumatismos e infecciones, pueden aumentar en exceso y provocar
cuadros confusionales (Broadhurst y Wilson, 2001).
El aumento de cortisol
circulante, como ocurre con el
estrés quirúrgico, puede agravar el delirium
a través de producir una mayor disfunción hipocampal, con independencia de que
esta aumente el hipercortisolismo.

Comentarios
Publicar un comentario