Neurobiologia del envejecimiento parte 2
El envejecimiento del sistema nervioso
Numerosos cambios sistémicos que ocurren durante el envejecimiento
potencialmente tienen impacto en el sistema nervioso. Sólo para mencionar algunos,
la diabetes mellitus (la hiperglicemia se asocia a glicación de proteínas que alteran
su función, y a daño oxidativo), alteraciones endocrinas (cambios en el
metabolismo celular, pérdida del efecto neurotrófico de varias hormonas), la
hipertensión arterial (daño vascular y alteraciones de perfusión), etc.
Es muy difícil descartar completamente la participación de estas
alteraciones dada su alta prevalencia y la variabilidad de su presentación. Sin
embargo, este trabajo se concentrará en cambios del sistema nervioso observados
en ausencia de entidades patológicas definidas, sistémicas o del sistema
nervioso, que podrían explicarlos.
Cambios neuropatológicos de
tipo degenerativos en el envejecimiento normal
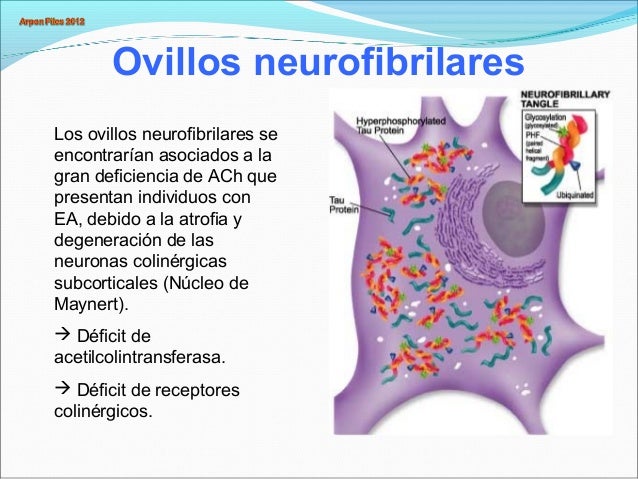
Características anatomopatológicas como las observadas en el cerebro de pacientes
con EA, particularmente los ovillos neurofibrilares, pueden encontrarse, aunque
en menor grado, en el cerebro de ancianos sin déficit cognitivo.
En cambio, la observación de placas amiloideas en regiones de la neocorteza
es mucho menos frecuente, y en general, aunque su prevalencia aumenta en
individuos muy añosos, su densidad se mantiene baja.
Por supuesto, persiste la duda si se trata de individuos que se encontraban
en estadios muy tempranos de un proceso neurodegenerativo en evolución, lo cual
no sorprende si consideramos que el envejecimiento es el factor de riesgo más importante
para la EA.

El envejecimiento normal además se acompaña del aumento de astrocitos y
microglías activadas, y de cambios neuronales. Se observa un aumento de los
astrocitos que expresan GFAP (proteína fibrilar acídica glial, un marcador de
activación) y S100B.
El aumento de S100B podría indicar una respuesta de protección, dado que promueve
la sobrevida neuronal y el crecimiento de neuritas.
La presencia de microglía también se incrementa durante el envejecimiento,
en especial microglías activadas, las que sobre-expresan Interleuquina 1 (IL-1)
y tienen características de células fagocíticas.
Este incremento en la activación microglial se observa incluso en ausencia de
otros cambios asociados al envejecimiento, sugiriendo que estos serían
primarios y no reactivos a otras alteraciones. Los cambios en el estado de activación
de la glía son especialmente relevantes dado que las glías son los principales
efectores y moduladores de la respuesta inflamatoria en el sistema nervioso.
En ese sentido, los cambios en la reactividad glial podrían ser en última instancia, los responsables de la potenciación en la respuesta inflamatoria y el estrés oxidativo que se observa en el sistema nervioso de individuos seniles.
Activación microglial e
inflamación en el envejecimiento
La inflamación y su regulación por citoquinas han sido asociadas a diversos
aspectos del envejecimiento del sistema nervioso. Se ha documentado ampliamente
el impacto de los mecanismos de inflamación en enfermedades degenerativas del sistema
nervioso. Sin embargo, no se puede confirmar que la inflamación efectivamente
tenga un papel específico en el envejecimiento.
Para entender su participación, tanto en el envejecimiento normal como en
el patológico, se debe considerar que las reacciones inflamatorias no son
necesariamente equivalentes; la microglía, responsable de la respuesta inmune
innata en el sistema nervioso, puede ser estimulada a producir cantidades importantes
de óxido nítrico (un mediador de inflamación de vida media corta clásico) sin hacerse
citotóxica, o viceversa.

Se plantea que, durante el envejecimiento, se establecería un mecanismo de
retroalimentación positivo, de manera que las células previamente enfrentadas a
un estímulo, responderán de manera más robusta a un nuevo estímulo,
potenciándose su efecto.
Este aumento progresivo de la posibilidad de respuesta microglial,
incrementa la probabilidad que se genere una respuesta inflamatoria. De hecho,
con la edad, la microglía tiende a producir más citoquinas después de una injuria.
La inyección de lipopolisacáridos (LPS, una endotoxina bacteriana), produce una
elevación más dramática de Interleuquina-6 (IL-6) y Factor de Necrosis Tumoral
(TNF) en animales de mayor edad.

La evidencia de cambios inflamatorios asociados a la edad es variable dependiendo si se evalúanlos niveles de citoquinas sistémicas (plasma) o en el sistema nervioso mismo. De hecho, el primero puede no reflejar la situación del segundo; de manera que el aumento de la citoquina proinflamatoria IL-1 intratecal puede disminuir la inflamación periférica. Consistente con este desacoplamiento, el complejo de histocompatibilidadmayor (MHC) de tipo II, con la edad, disminuye en los macrófagos periféricos mientras aumenta en la microglía. Así, si bien se describe que citoquinas pro-inflamatorias, como IL-1, IL-6 y TNFα, y sus receptores, aumentan con la edad, la posibilidad de acceder a una respuesta definitiva se ve impedida por la dificultad de medir citoquinas en el parénquima cerebral de un individuo sano.
Por lo anterior, mucho del conocimiento que tenemos hoy, depende de
estudios enanimales. Citoquinas anti-inflamatorias como Interleuquina-10
(IL-10) y Factor de Crecimiento
Transformante-β (TGFb) también se elevarían en el envejecimiento. Sin
embargo, para entender la asociación de inflamación y envejecimiento, es más
importante la elevación de indicadores de inflamación río abajo, como los
niveles de complemento C1q, lo que no podría observarse si el incremento de los
factores anti-inflamatorios fuese suficiente como para mantener el balance.
El aumento de IL-6 plasmático en individuos añosos es uno de los hallazgos
más consistentes, lo que tendría un valor
predictivo para la aparición de alteraciones, incluyendo alteraciones cognitivas,
en el futuro.
Estudios animales también muestran un incremento de IL-6 en hipocampo y
corteza cerebral asociado al envejecimiento, especialmente en las microglías
. La participación de IL-6 parece ser especialmente compleja, dado que en
humanos, el polimorfismo genético asociado al aumento de IL-6 se asocia a una
ventaja de sobrevida y la mayor concentración de IL-6 en el líquido céfalo
raquídeo se asocia a un mejor resultado frente a daño cerebral traumático.
Estrés oxidativo y
envejecimiento
El metabolismo energético intrínseco a la mantención del organismo, y
factores ambientales (polución, tabaquismo), determinan la generación continua
de radicales de oxígeno. Estos radicales producen daño oxidativo en lípidos,
proteínas y ADN, y las moléculas dañadas se acumulan durante el envejecimiento.
El deterioro secundario al envejecimiento se observa más claramente en células
post-mitóticas, las cuales, al ser dañadas, no pueden ser reemplazadas por
células nuevas, como es el caso de la neurona.
Si bien no se ha podido demostrar con certeza cual es el papel de este daño
en la senescencia, el estrés oxidativo sería uno de los mecanismos posiblemente
involucrados en las enfermedades neurodegenerativas
El estrés oxidativo puede incrementarse en el envejecimiento tanto por
el aumento en la generación de radicales de oxígeno, como por la disminución de
la capacidad de eliminar estos radicales (mecanismos anti-oxidantes). Aún hay discusión
respecto a la aparente disminución de los mecanismos anti-oxidantes durante el
envejecimiento.
Sin embargo, las evidencias disponibles, con respecto a la vida máxima de
los individuos, sugieren que los mecanismos de defensa contra oxidación no serían
muy relevantes. Los niveles de enzimas anti-oxidantes y los anti-oxidantes de bajo
peso molecular muestran una correlación inversa con la longevidad máxima de los
animales, lo que indica la actividad pro-oxidativa como tal es lo más
relevante.
Tampoco se ha encontrado que la suplementación con antioxidantes o el efecto
contrario, la eliminación de mecanismos antioxidantes, modifique en forma
significativa la sobrevida máxima de un animal. En cambio, estudios de la sobrevida
promedio sugieren que en los animales tratados con terapia anti-oxidante, estos
pueden ser protectores no específicos efectivos para diversas causas de
mortalidad temprana.
Estos efectos protectores pueden tener gran importancia para la población
humana dado quepor sus condic iones de vida, el hombre habita en un medio
ambiente adverso, sometido por ejemplo a radiaciones y compuestos tóxicos, por
lo que están expuestos a daño por estrés oxidativo de origen exógeno.
El sistema nervioso es especialmente susceptible a sufrir daño oxidativo
debido a varios factores, entre los que se destacan su alto consumo de oxígeno,
su dependencia en el metabolismo aeróbico de carbohidratos y su compleja
composición de lípidos de membrana.
Los radicales libres son generados en muchos sitios celulares, pero la
cadena respiratoria mitocondrial es una de sus fuentes principales. Al
respecto, los animales tendrían mecanismos reguladores activos durante el
desarrollo que monitorizarían la actividad mitocondrial y, en respuesta,
establecerían las tasas de respiración, comportamiento y envejecimiento que
persisten durante la vida adulta.
Si bien muchos de estos estudios han sido realizados en animales (incluso
invertebrados, como c. elegans en el manuscrito recién mencionado), los
resultados son relevantes en cuanto nos sugieren que al menos algunas de las
intervenciones dirigidas a disminuir los efectos del envejecimiento, tendrán
que plantearse en etapas tempranas y no durante la vida adulta del individuo
Aunque los radicales afectan a diversas macromoléculas, incluyendo proteínas,
lípidos y ADN, el daño al ADN parece ser especialmente importante para el envejecimiento
(más aún para células post-mitóticas como las neuronas).
Los radicales generados en la mitocondria, dada su vida media extremadamente
corta, dañan especialmente estructuras de la matriz mitocondrial, como el ADN
mitocondrial (ADNmt), perturbando aún más la función mitocondrial. Las
mutaciones en el ADNmt, tanto deleciones como mutaciones puntuales, se acumulan
en el envejecimiento y se expanden clonalmente, con las consecuentes alteraciones
para la función celular.
Las alteraciones pueden incluir la depresión de la respiración celular, el
aumento de la formación de radicales y el aumento de la susceptibilidad a la
apoptosis gatillada por el estrés oxidativo; además de la liberación de
radicales al extracelular con el daño consiguiente a las células vecinas.
La alteración de la degradación lisosomal de mitocondrias que han sufrido
daño oxidativo también contribuye al proceso de envejecimiento
Basada en los estudios que asocian el aumentodel estrés oxidativo al
envejecimiento, se ha potenciado una línea de investigación que propone que la
disminución de la ingesta calórica se asocia a un incremento de la resistencia
del sistema nervioso a sufrir los desórdenes neurodegenerativos del envejecimiento.
El efecto neuroprotector dependería de la disminución en la generación de
radicales de oxígeno y a un incrementoen la producción de factores
neurotróficos y chaperonas de proteínas.
Regulación del Calcio y
expresión génica en el envejecimiento
Trabajos desarrollados en las últimas 2 décadas sugieren que cambios
discretos en la regulación del calcio podrían modular gradualmente el
envejecimiento cerebral normal, y al mismo tiempo, aumentar su vulnerabilidad a
enfermedades neurodegenerativas como la EA.
La señalización por calcio
depende de la elevación transitoria de su concentración intracelular. Esta elevación
gatilla, en forma selectiva, diferentes vías de señalización, dependiendo de la
concentración del calcio y de sus características temporales y espaciales
. La regulación de la homeostasis del calcio en las células cerebrales se
perdería en forma temprana durante el envejecimiento, alterándose múltiples vías
de señalización y afectando en forma adversa la fisiología celular y diversas funciones
moleculares
En el cerebro de individuos envejecidos, se ha observado la existencia de un aumento de la postdespolarización dependiente de calcio, aparentemente secundaria al aumento de canales de calcio voltaje-dependiente tipo-L, lo que se asociaría en forma consistente a la alteración de la función neuronal y de los procesos cognitivos. Además, la célula produce elevaciones mayores del calcio en respuesta a un estímulo dado.
El retículo endoplásmico parece jugar un papel importante en la regulación
del calcio, y de hecho, su capacidad de secuestrar calcio libre en las neuronas
disminuye con la edad.
Otro organelo subcelular importante para la regulación del calcio, es la
mitocondria. Como ya se mencionó previamente, en el envejecimiento normal
también existe una disminución generalizada de la capacidad funcional mitocondrial.
Aunque el mecanismo exacto se desconoce, se observa una disminución en la
actividad de varios de los complejos proteicos de la cadena transportadora de
electrones
Es relevante que muchos de los cambios en la homeostasis del calcio y en la
función mitocondrial no afectan a la célula en condiciones de reposo, sino que
se manifiestan sólo en condiciones de actividad, lo que probablemente es reflejo
de sus condiciones limitantes en la regeneración energética.
Como resultado de las alteraciones en la homeostasis del calcio, y
particularmente durante períodos de actividad neuronal intensa, el calcio se
mantiene ya sea más elevado o por más tiempo, pudiendo activar de manera
excesiva una variedad de respuestas tales como la excitabilidad de membrana, reorganización
del citoesqueleto y extensión de procesos neurales, plasticidad sináptica,
adhesión celular, inflamación, regulación del ciclo celular, crecimiento y
muerte celular. En los últimos años, se ha visto que estas respuestas son mediadas,
al menos parcialmente, a través de la regulación de la expresión génica por la
cascada de señalización del calcio.
Estos cambios en la expresión génica no son una respuesta tardía a la
degeneración, sino que se asocian al inicio de las alteraciones cognitivas.
Varios genes que regulan el metabolismo energético mitocondrial se
encuentran disminuidos, correlacionándose positivamente con alteraciones del
comportamiento.
Función sináptica y
envejecimiento
Mencionamos que se ha observado en animales añosos la existencia de cambios
funcionales y bioquímicos en circuitos neuronales, los que se asocian a cambios
en la función sináptica.
Por ejemplo, se ha observado una disminución de la activación sináptica en
rebanadas de hipocampo y en la corteza prefrontal.
En humanos también se plantea la existencia de una pérdida de sinapsis
durante el envejecimiento, en ausencia de patología degenerativa; aunque
siempre es difícil diferenciar la alteración leve estable del envejecimiento,
de los estadios tempranos pero progresivos de una patología neurodegenerativa.
Los circuitos neuronales involucrados con las actividades cognitivas (corteza entorrina
e hipocampo) tienen poca redundancia; por ende es pensable que los mismos
circuitos hipocampales y neocorticales comprometidos en la EA, serían los
vulnerables al compromiso sináptico que determina las alteraciones cognitivas asociadas
a la edad. Estudios en rata y mono muestran que las funciones de memoria
asociadas al lóbulo temporal medio declinan con la edad, aunque no se
manifiestan en todos los individuos.
Parece poco probable que el déficit se deba a pérdida celular, ya que ésta,
cuando presente, es muy discreta y acotada. En cambio, hay evidencia de la existencia
de cambios regresivos asociados a edad en las arborizaciones y espinas dendríticas
en regiones corticales tanto en humanos como en primates no-humanos.
Se observan cambios morfológicos en las dendritas y una reducción de la
densidad de espinas sinápticas en individuos mayores de 50 años cercana al 50%,
comparado a individuos menores.
Dado que las espinas representan los sitios postsinápticos principales de
las sinapsis excitatorias, su reducción refleja la disminución de las
densidades sinápticas. Estas alteraciones sinápticas además se asocian a la
disminución de la expresión de receptores de glutamato del tipo AMPA y NMDA,
entre otros cambios.
Estos cambios sinápticos y dendríticos en oportunidades también son acompañados
de la degeneración de axones mielínicos en las capas profundas de la corteza y
en la sustancia blanca, lo que parece asociarse a déficit en pruebas visuales y
de reconocimiento espacial en animales añosos.
Estos cambios ultra estructurales mielínicos indican que los déficit cognitivos
asociados a la edad no se deben a la pérdida de neuronas, sino que podrían evolucionar
a partir de la disrupción de la conectividad cortical.
Además de los defectos cortico-corticales, la edad también afecta los
sistemas colinérgicos y monoaminérgicos que proyectan desde la región frontal
basal y mescencéfalo. Un dato importante es que los déficit en estos sistemas
asociados a la edad, parecen responder favorablemente a la administración de
hormonas y neurotrofinas.
Con respecto a los circuitos hipocampales, los mismos que son vulnerables a
daño en la EA, son vulnerables a alteraciones sinápticas en el envejecimiento, por
lo que es probable que haya déficit de memoria. Los cambios se observan en
ausencia de pérdida neuronal en la corteza entorrina, sugiriendo la existencia
de alteraciones dendríticas manifestadas fundamentalmente como cambios funcionales
de las sinapsis sin mayores cambios morfológicos.
Así, el substrato para el déficit funcional hipocampal sería
fundamentalmente la alteración del perfil molecular de las sinapsis, en contraste
a la pérdida de sinapsis; de tal modo que las alteraciones sinápticas
relacionadas a la edad pueden manifestarse ya sea estructuralmente (disminución
de sinapsis) o a través de cambios sinápticos moleculares, pero sin muerte
neuronal.
Otra área de interés es la interfase entre senescencia endocrina y el
envejecimiento neural.
Se sabía que la densidad de espinas dendríticas en el hipocampo era
sensible a las fluctuaciones de estrógeno en ratas jóvenes, y que el número de
espinas y sinapsis se modificaban en respuesta a la depleción y reemplazo
hormonal experimentales.
Sin embargo, se observó que las sinapsis de ratas envejecidas reaccionan
diferente al estrógeno.
En ellas, la terapia de reemplazo no inducía cambios en el número, aunque
sí en cuanto al perfil de receptores NMDA de las sinapsis. Estas diferencias asociadas
a la edad, y que sugieren la existencia de una “ventana de oportunidad
terapéutica”, podrían explicar el fracaso de la terapia de reemplazo como
protección contra la EA y el deterioro cognitivo mínimo en el estudio “women’s
health initiative memory study”(31), dado que las mujeres incluidas eran
menopaúsicas de larga data y no perimenopaúsicas.
Ensayos en primates no-humanos mostraron que monos de edad equivalente a la
de mujeres perimenopaúsicas, eran tan sensibles al estrógeno como monos jóvenes,
presentando un aumento en el número de sinapsis una mejoría en su función sináptica.
Estos resultados sugieren que estos circuitos neuronales vulnerables al
envejecimiento responden a terapia sólo si ésta se administra sin mediar un
período extenso de depleción.

Comentarios
Publicar un comentario